Matabolismo degli Amminoacidi
Il metabolismo degli amminoacidi é fondamentale per gli esseri viventi, poichè oltre alla sintesi proteica, essi possono avere altre importanti destinazione come ad esempio ottenere energia ecc, . Di notevole rilevanza é pure conoscere attraverso quali modalità essi possono essere resi disponibili e in questo senso parleremo di "pool di Amminoacidi"
Cos'é il "pool" di amminoacidi?
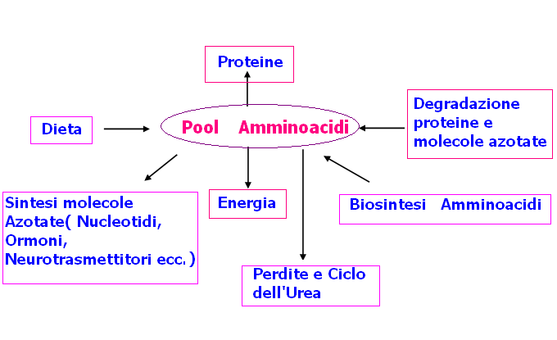
Si intende l'insieme di amminoacidi disponibili per le varie esigenze. Gli apporti sono dovuti: alla dieta , alla degradazione delle proteine esistenti, alla biosintesi di amminoacidi non essenziali.
Qual'é l'utilizzo degli amminoacidi del pool?
Da questo « pool » derivano gli aminoacidi utilizzati per i differenti destini metabolici e che possono essere così schematizzati:
1) utilizzazione diretta per la sintesi di nuove proteine,
2) biosintesi di composti azotati non proteici (purine, pirimi-
dine, porfirine, adrenalina, tiroxina, ecc.),
3) biosintesi di aminoacidi non essenziali (transaminazione, ecc. ),
4) rimozione del gruppo aminico dell'aminoacido (desaminazione) con formazione di urea;
5)il residuo carbonioso può essere a) convertito in glucoso, b) convertito in grasso, e) destinato a particolari metabolismi.
Dove e quando avviene la transeminazione?
Il processo di transamminazione, avviene principamente nel fegato: è regolato dalla attivazione o inattivazione degli enzimi specifici (transamminasi) da parte delle quote amminoacidiche che provengono dagli alimenti.
I 20 diversi aminoacidi che costituiscono il « pool » devono essere presenti in quantità adeguate tuttavia, tuttavia se ciò non fosse, si ha un riequilibrio utilizzando l'azoto degli aminoacidi in eccesso per sintetizzare quelli « non essenziali » in quel momento richiesti.
In quale modo influisce la dieta?
Ad esempio una dieta iperproteica (ad esempio, molto ricca di carni e formaggi) attiva le transamminasi specifiche per quegli amminoacidi che sono in eccesso, mentre una dieta iperglucidica (quantità eccessiva di pane e pasta) ha un effetto opposto. Un eccesso di carboidrati infatti fa secernere l'insulina che obbliga il glucosio ad entrare nelle cellule, attiva la glicolisi e inibisce la gluconeogenesi inattivando le transamminasi che generano gli alfa-chetoacidi.
Gli ormoni antagonisti dell'insulina come il glucagone hanno una azione opposta a questo ormone, attivano la gluconeogenesi e la demolizione delle proteine.
Il metabolismo degli amminoacidi dipende, allora, principalmente dalla quantità di proteine e glucidi introdotti con gli alimenti che regolano l'attività delle transamminasi epatiche, dal ciclo del glucosio-alanina ( vedi dopo)che mantiene costanti i livelli di amminoacidi e glucosio rispettivamente nei tessuti periferici e nel sangue e, infine, dipende dalla regolazione e dal controllo dell'insulina e dei suoi ormoni antagonisti che hanno il compito di coordinare fra loro i metabolismi dei carboidrati, lipidi e amminoacidi.
Quali enzimi catalizzano la Transaminazione?
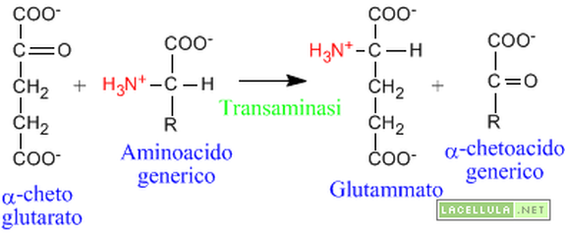
La transaminasi (o amminotransferasi) sono una classe di enzimi che catalizzano il trasferimento del gruppo aminico di un qualsiasi aminoacido verso un accettore che in genere è l'alpha-chetoglutarato (vedi reazione sotto). In questo modo viene usata una sola molecola per tutti gli aminoacidi, ottimizzando l'intero processo al posto di usare un accettore specifico per ogni aminoacido. Il trasferimento del gruppo aminico comporta la formazione dell'aminoacido glutammato e dell'alpha-chetoacido corrispondente all'aminoacido di partenza.
Esistono transaminasi specifiche per ogni amminoacido che come coenzima utilizzano il Piridossal-Fostato (PLP,trasportatore di gruppi aminici -NH2, derivato dalla vitamina B6) e consentono l’interconversione di 18 AA su 20 e comportano tutte come reagenti glutamato e alfa-chetoglutarato (alfa-chetoacido*).Le reazioni di transaminazione sono reversibili, hanno Keq prossime all’unità e ΔG’° prossimo a zero (praticamente reagenti e prodotti sono presenti in uguale concentrazione) e quindi la loro direzione si sposta dipendentemente dalle concentrazioni dei reagenti.
Cos'é un alfa chetoacido?
E' un acido acido con gruppo chetonico C=O adiacente al carbossile -COOH. Esempio: acido piruvico: : CH3-CO-COOH .
Transaminazione in dettaglio
L'uomo ricava gli amminoacidi non essenziali, come detto, attraverso la transamminazione, così l'a-chetoglutarato è la base di partenza per il glutammato, la glutammina, l'arginina e la prolina.
Il piruvato e l'ossalacetato sono rispettivamente i precursori per l'alanina e l'aspartato.
Come avviene la reazione?
La reazione avviene tra un aminoacido e un acido alfa-cheto. Il gruppo amminico viene trasferito e il risultato è che l'aminoacido che reagisce si trasforma nell'αlfa cheto acido corrispondente, mentre l'alfa chetoacido che reagisce viene convertito nell'amminoacido corrispondente( nel nostro caso in glutammato).
L'amminoacido più attivo nella transamminazione è il L-glutammato, mentre Il chetoacido che più frequentemente si combina con questo è l'a-chetoglutarato, un intermedio del ciclo di Krebs.
Il glutammato e l'a-chetoglutarato sono due molecole che, nella cellula, sono sempre disponibili in grandi quantità.
L'alfa-chetoglutarato come intermedio del ciclo di Krebs è un metabolita sempre presente nei mitocondri, il glutammato è un amminoacido che viene sintetizzato anche direttamente dall'alfa-chetoglutarato perché l'organismo utilizza questa molecola in diversi metabolismi e con finalità diverse.
Il metabolismo dei carboidrati(glicolisi e ciclo di Krebs) fornisce anche altri alfa -chetoacidi (ossalacetato, piruvato) che vengono utilizzati nei processi di transamminazione.
Vediamo come esempio la L-alanina che viene trasformata in L-aspartato. In questa trasformazione vengono coinvolti gli enzimi glutammico-piruvico transamminasi (GPT) ed il glutammico ossalacetico transamminasi (GOT). Le reazioni sono le seguenti:
GPT
1) alanina + a-chetoglutarato --------> piruvato + glutamato
GOT
2) glutamato + ossalacetato ----------> a-chetoglutarato + aspartato
GPT* = glutamico-piruvico-transaminasi (isoenzima)
GOT*= glutamico-ossalacetico-transaminasi (isoenzima)
Se nelle analisi del sangue i valori di GOT e GPT sono più alti della norma, ciò può indicare una sofferenza epatica o cardiaca (infarto), per cui vanno fatti ulteriori accertamenti.n corso di danno epatico, muscolare scheletrico o cardiaco
Quali sono gli amminoacidi non interessati dalla Transaminazione?
Lisina e treonina sono gli unici due amminoacidi che non sempre sono sottoposti transaminazione.
Il piruvato e l'ossalacetato sono rispettivamente i precursori per l'alanina e l'aspartato.
Come avviene la reazione?
La reazione avviene tra un aminoacido e un acido alfa-cheto. Il gruppo amminico viene trasferito e il risultato è che l'aminoacido che reagisce si trasforma nell'αlfa cheto acido corrispondente, mentre l'alfa chetoacido che reagisce viene convertito nell'amminoacido corrispondente( nel nostro caso in glutammato).
L'amminoacido più attivo nella transamminazione è il L-glutammato, mentre Il chetoacido che più frequentemente si combina con questo è l'a-chetoglutarato, un intermedio del ciclo di Krebs.
Il glutammato e l'a-chetoglutarato sono due molecole che, nella cellula, sono sempre disponibili in grandi quantità.
L'alfa-chetoglutarato come intermedio del ciclo di Krebs è un metabolita sempre presente nei mitocondri, il glutammato è un amminoacido che viene sintetizzato anche direttamente dall'alfa-chetoglutarato perché l'organismo utilizza questa molecola in diversi metabolismi e con finalità diverse.
Il metabolismo dei carboidrati(glicolisi e ciclo di Krebs) fornisce anche altri alfa -chetoacidi (ossalacetato, piruvato) che vengono utilizzati nei processi di transamminazione.
Vediamo come esempio la L-alanina che viene trasformata in L-aspartato. In questa trasformazione vengono coinvolti gli enzimi glutammico-piruvico transamminasi (GPT) ed il glutammico ossalacetico transamminasi (GOT). Le reazioni sono le seguenti:
GPT
1) alanina + a-chetoglutarato --------> piruvato + glutamato
GOT
2) glutamato + ossalacetato ----------> a-chetoglutarato + aspartato
GPT* = glutamico-piruvico-transaminasi (isoenzima)
GOT*= glutamico-ossalacetico-transaminasi (isoenzima)
Se nelle analisi del sangue i valori di GOT e GPT sono più alti della norma, ciò può indicare una sofferenza epatica o cardiaca (infarto), per cui vanno fatti ulteriori accertamenti.n corso di danno epatico, muscolare scheletrico o cardiaco
Quali sono gli amminoacidi non interessati dalla Transaminazione?
Lisina e treonina sono gli unici due amminoacidi che non sempre sono sottoposti transaminazione.
Deamminazione e ciclo dell'Urea
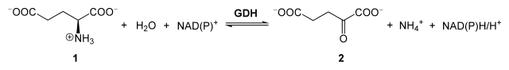
Quali amminoacidi subiscono la deamminazione?
Con la dieta vengono introdotti gli aminoacidi, assieme alle altri classi di molecole utili per il metabolismo dell'organismo. Gli aminoacidi introdotti in eccesso, però, non vengono utilizzati per la costituzione di proteine di riserva e, per questo motivo, devono essere metabolizzati per entrare nei cicli di sintesi delle molecole di riserva. In altre parole lo scheletro carbonioso degli aminoacidi viene utilizzato per creare altre molecole.
L'ostacolo da superare, per la riutilizzazione della parte carboniosa degli aminoacidi, è il gruppo aminico presente in alpha. Questo gruppo non può essere metabolizzato e deve essere rimosso mediante il processo di deaminazione con la produzione di ammoniaca (vedi reazinbe sopra) o con la transaminazion come visto in precedenza.
Come viene rimossa l'ammoniaca?
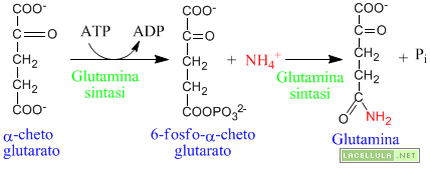
Nei tessuti l'ammoniaca è una molecola tossica per cui è necessario portarla altrove per la sua esplusione. Il glutammato, in questo, caso, agisce in modo indiretto formando glutammina mediante l'azione dell'enzima glutamina sintasi. Il primo passaggio di questa reazione è la fosforilazione del carbossile terminale del glutammato seguito dalla sua sostituzione dello ione ammonio.
Cosa succede a livello muscolare?
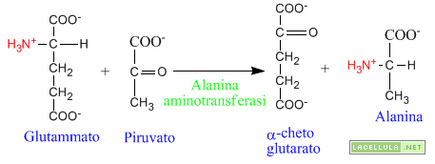
Nel tessuto muscolare, inoltre, la via di trasporto dell'ammoniaca è particolare. A seguito della glicolisi si forma un quantitativo elevato di piruvato. Questo chetoacido accetta un gruppo amminico dal glutammato mediante l'intervento dell'enzima alanina aminotransferasi con la conseguente sintesi dell'alanina. L'alanina così formata si dirige dal muscolo al fegato trasportando con sé il gruppo aminico. Nel fegato il gruppo amminico viene allontanato per entrare nel ciclo dell'urea, mentre i forma nuovamente piruvato che entra nella gluconeogenesi per formare il glucosio. Per questo motivo questo particolare processo di eliminazione dello ione ammonio viene definito ciclo glucosio-alanina.
Quadro complessivo del ciclo dell'Urea.
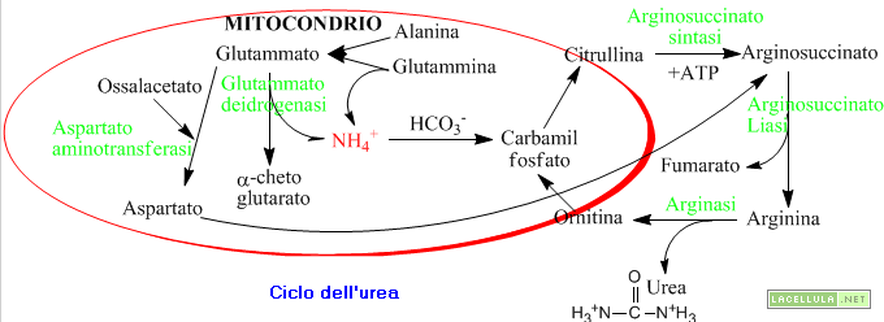
Lo ione ammonio rimosso dagli amminoacidi, anche a concentrazioni molto basse, è molto tossico per il cervello, sia per la sua elevata basicità, sia perché, legandosi con a-chetoglutarato (si forma L-glutammato), sottrae questa molecola al ciclo di Krebs, che potrebbe bloccarsi con le ovvie conseguenze che ne deriverebbero.
Il luogo di raccolta di questo azoto è rappresentato dagli epatociti e, precisamente, l'organello è il mitocondrio. Qui l'ammoniaca viene "rilasciata" dai trasportatori, appena menzionati e per effetto dell'enzima carbamil fosfato sinteasi viene tradotta in carbamil fosfato.
Il carbamil fosfato appena introdotto entra nel ciclo dell'urea che è un sistema di reazioni che avvengono in parte nel mitocondrio ed in parte nel citosol. L'ornitina è un aminoacido non proteinogenico, e reagisce con il carbamil fosfato per formare un altro aminoacido non proteinogenico: la citrullina. Questo intermedio reagisce con l'aspartato, formato nel mitocondrio precedentemente, e forma arginosuccinato in una reazione che comporta la spesa di una molecola di ATP. L'arginosuccinato viene idrolizzato in fumarato ed arginina e, quest'ultima, per mezzo dell'enzima arginasi, perde una molecola di urea e riforma l'ornitina che rientra nel mitocondrio e continua il ciclo.
