Gli Enzimi
Casa sono gli enzimi?
Sono dei catalizzatori biologici, generalmente di origine proteica che svolgono la funzione di catalizzatori delle reazioni biologiche.
Quale struttura hanno?
Gli enzimi proteici presentano una struttura terziaria (ovvero la conformazione tridimensionale) e una struttura struttura quaternaria (ovvero l'arrangiamento spaziale delle subunità) che ne determinano l’attività.
La regione dell'enzima coinvolta nell'attività catalitica è molto ridotta (conta spesso solo 3-4 amminoacidi). La regione contenente questi residui catalitici, nota come sito attivo,
Quali caratteristiche hanno gli enzimi?
1) gli enzimi non sono consumati dalla reazione che catalizzano e al termine della reazione, liberato il prodotto , rimangono disponibili per iniziarne una nuova
2) non alterano l'equilibrio chimico della reazione, il prodotto viene allontanato dall'enzima,.
3) La maggior parte degli enzimi presenta una notevolissima specificità per la reazione catalizzata e per i substrati coinvolti. Tale specificità è legata a diversi fattori che caratterizzano l'associazione tra il substrato ed il sito attivo, come la complementarietà dal punto di vista strutturale (sono sensibili anche a piccolissime differenze della struttura tridimensionale), le cariche elettriche, la natura idrofila o idrofoba.
Sono dei catalizzatori biologici, generalmente di origine proteica che svolgono la funzione di catalizzatori delle reazioni biologiche.
Quale struttura hanno?
Gli enzimi proteici presentano una struttura terziaria (ovvero la conformazione tridimensionale) e una struttura struttura quaternaria (ovvero l'arrangiamento spaziale delle subunità) che ne determinano l’attività.
La regione dell'enzima coinvolta nell'attività catalitica è molto ridotta (conta spesso solo 3-4 amminoacidi). La regione contenente questi residui catalitici, nota come sito attivo,
Quali caratteristiche hanno gli enzimi?
1) gli enzimi non sono consumati dalla reazione che catalizzano e al termine della reazione, liberato il prodotto , rimangono disponibili per iniziarne una nuova
2) non alterano l'equilibrio chimico della reazione, il prodotto viene allontanato dall'enzima,.
3) La maggior parte degli enzimi presenta una notevolissima specificità per la reazione catalizzata e per i substrati coinvolti. Tale specificità è legata a diversi fattori che caratterizzano l'associazione tra il substrato ed il sito attivo, come la complementarietà dal punto di vista strutturale (sono sensibili anche a piccolissime differenze della struttura tridimensionale), le cariche elettriche, la natura idrofila o idrofoba.
Come intervengono nella a reazione?
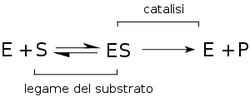
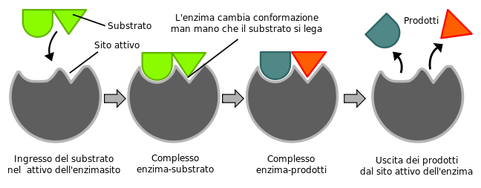
L'enzima si lega al substrato , catalizza la reazione e alla fine viene liberato per riprendere il ciclo.
Cos'é il sito attivo?
Il sito attivo di un enzima è la porzione di molecola direttamente implicata nel processo di catalisi e nella formazione dei legami con i reagenti.
I substrati si legano al sito attivo dell'enzima tramite legami idrogeno, interazioni idrofobiche, legami covalenti temporanei o una combinazione di questi legami. Anche gli inibitori con meccanismi che vedremo possoni legarsi al sito attivo.
In questo modo il sito attivo modifica il meccanismo di reazione conducendo a un percorso al quale è associato minore energia di attivazione. Il prodotto legato al sito attivo è solitamente instabile a causa del'impedimento sterico e quindi tende a essere liberato ricostituendo in tal modo l'enzima originario.
Cos'é l'impedimento sterico?
L'ingombro sterico, in chimica è il fenomeno prodotto dalla vicendevole repulsione elettrostatica tra le nubi elettroniche degli atomi e dei legami che formano una molecola dovuta alla loro sovrapposizione o eccessivo avvicinamento. La molecola, a causa di ciò, assume una conformazione spaziale determinata.
L'ingombro conseguente può intralciare l'avvicinamento di una molecola ad un'altra, oppure l'eliminazione di un gruppo ingombrante può essere velocizzata dalla diminuzione dell'ingombro della molecola. In altri casi può succedere che una reazione che potrebbe avvenire su due gruppi funzionali avviene preferenzialmente su quello che si trova in una zona meno stericamente ingombrata.
Cosa sono i Coenzimi?
I coenzimi, sono molecole di natura non proteica in genere vitamine idrosolubili, oppure gli ioni metallici che associandosi agli enzimi ne rende possibile l'attività catalitica, infatti la loro azione consiste nell'operare sulla struttura enzimatica permettendole di combinarsi col substrato.
Di solito partecipano a reazioni che comportano il trasferimento di qualche specie chimica (come un elettrone, un protone, un gruppo fosfato), essi fungono da accettore temporaneo di questi gruppi.
Il sito attivo di un enzima è la porzione di molecola direttamente implicata nel processo di catalisi e nella formazione dei legami con i reagenti.
I substrati si legano al sito attivo dell'enzima tramite legami idrogeno, interazioni idrofobiche, legami covalenti temporanei o una combinazione di questi legami. Anche gli inibitori con meccanismi che vedremo possoni legarsi al sito attivo.
In questo modo il sito attivo modifica il meccanismo di reazione conducendo a un percorso al quale è associato minore energia di attivazione. Il prodotto legato al sito attivo è solitamente instabile a causa del'impedimento sterico e quindi tende a essere liberato ricostituendo in tal modo l'enzima originario.
Cos'é l'impedimento sterico?
L'ingombro sterico, in chimica è il fenomeno prodotto dalla vicendevole repulsione elettrostatica tra le nubi elettroniche degli atomi e dei legami che formano una molecola dovuta alla loro sovrapposizione o eccessivo avvicinamento. La molecola, a causa di ciò, assume una conformazione spaziale determinata.
L'ingombro conseguente può intralciare l'avvicinamento di una molecola ad un'altra, oppure l'eliminazione di un gruppo ingombrante può essere velocizzata dalla diminuzione dell'ingombro della molecola. In altri casi può succedere che una reazione che potrebbe avvenire su due gruppi funzionali avviene preferenzialmente su quello che si trova in una zona meno stericamente ingombrata.
Cosa sono i Coenzimi?
I coenzimi, sono molecole di natura non proteica in genere vitamine idrosolubili, oppure gli ioni metallici che associandosi agli enzimi ne rende possibile l'attività catalitica, infatti la loro azione consiste nell'operare sulla struttura enzimatica permettendole di combinarsi col substrato.
Di solito partecipano a reazioni che comportano il trasferimento di qualche specie chimica (come un elettrone, un protone, un gruppo fosfato), essi fungono da accettore temporaneo di questi gruppi.
Qual'é il meccanismo di azione del sito attivo?
I meccanismi di azione sono due: Chiave-serratura e adattamento indotto
a)Il primo modello proposto a fine ottocento, afferma che l'enzima ed il substrato possiedono una forma esattamente complementare che ne permette un incastro perfetto. Tale modello spiega bene la specificità degli enzimi, ma è decisamente meno affidabile nello spiegare la stabilizzazione dello stato di transizione che l'enzima raggiunge durante il legame con il substrato.
b)Tale modello oggi sembra superato a favore dell'adattamento indotto, in pratica si pensa che il sito attivo possa continuamente modellarsi in base alla presenza o meno del substrato. Come risultato, il substrato non si lega semplicemente ad un sito attivo rigido, ma genera un rimodellamento del sito stesso, che lo porta ad un legame più stabile in modo da portare correttamente a termine la sua attività catalitica..
I meccanismi di azione sono due: Chiave-serratura e adattamento indotto
a)Il primo modello proposto a fine ottocento, afferma che l'enzima ed il substrato possiedono una forma esattamente complementare che ne permette un incastro perfetto. Tale modello spiega bene la specificità degli enzimi, ma è decisamente meno affidabile nello spiegare la stabilizzazione dello stato di transizione che l'enzima raggiunge durante il legame con il substrato.
b)Tale modello oggi sembra superato a favore dell'adattamento indotto, in pratica si pensa che il sito attivo possa continuamente modellarsi in base alla presenza o meno del substrato. Come risultato, il substrato non si lega semplicemente ad un sito attivo rigido, ma genera un rimodellamento del sito stesso, che lo porta ad un legame più stabile in modo da portare correttamente a termine la sua attività catalitica..