INIBITORI
Cos'é un inibitore enzimatico?
Con il termine inibitore enzimatico si indica una molecola in grado di instaurare un legame chimico con un enzima, diminuendone così l'attività. L'inibitore infatti può intralciare l'enzima nella catalisi , per esempio impedendo al substrato di entrare nel sito attivo dell'enzima stesso. Il legame tra enzima ed inibitore può essere reversibile o irreversibile. Gli inibitori irreversibili solitamente reagiscono con l'enzima, modificando chimicamente residui amminoacidici fondamentali per l'attività.
Gli inibitori reversibili si legano non-covalentemente e producono diversi tipi di inibizione a seconda che si leghino all'enzima, al complesso enzima-substrato, o ad entrambi.
Cos'é un attivatore enzimatico?
Agli enzimi possono legarsi anche molecole in grado di potenziarne l'attività, dette attivatori enzimatici. Alcune di queste molecole non sono indispensabili per la catalisi, ma la loro presenza la facilita.
Gli inibitoro agiscono solo sull'enzima?
Alcuni inibitori reagiscono anche con i cofattori e i coenzimi che come noto sono sostanze indispensabili per l'attività enzimatica e la loro assenza non rende possibile il meccanismo enzimatico.
Cos'é un inibitore competitivo?
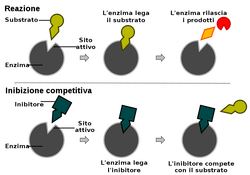
Un inibitore competitivo è un inibitore enzimatico che segue un meccanismo di inibizione competitiva (reversibile), ovvero compete con il substrato per il legame con il sito attivo dell'enzima.
Con quale meccanismo agisce?
L'inibitore competitivo si lega al sito attivo impedisce il legame con il substrato. L'effetto è quello di diminuire la concentrazione di enzima libero disponibile a reagire.
All'aumentare della concentrazione di inibitore diminuisce la velocità della reazione, a meno che non si aumenti anche la concentrazione di substrato.
.In conclusione il livello di inibizione dipende dunque sia dalla concentrazione di inibitore che da quella di substrato. Spesso gli inibitori competitivi hanno una forma simile a quella dei substrati di cui inibiscono il legami cioé sono strutturalmente simili al vero substrato.
Con il termine inibitore enzimatico si indica una molecola in grado di instaurare un legame chimico con un enzima, diminuendone così l'attività. L'inibitore infatti può intralciare l'enzima nella catalisi , per esempio impedendo al substrato di entrare nel sito attivo dell'enzima stesso. Il legame tra enzima ed inibitore può essere reversibile o irreversibile. Gli inibitori irreversibili solitamente reagiscono con l'enzima, modificando chimicamente residui amminoacidici fondamentali per l'attività.
Gli inibitori reversibili si legano non-covalentemente e producono diversi tipi di inibizione a seconda che si leghino all'enzima, al complesso enzima-substrato, o ad entrambi.
Cos'é un attivatore enzimatico?
Agli enzimi possono legarsi anche molecole in grado di potenziarne l'attività, dette attivatori enzimatici. Alcune di queste molecole non sono indispensabili per la catalisi, ma la loro presenza la facilita.
Gli inibitoro agiscono solo sull'enzima?
Alcuni inibitori reagiscono anche con i cofattori e i coenzimi che come noto sono sostanze indispensabili per l'attività enzimatica e la loro assenza non rende possibile il meccanismo enzimatico.
Cos'é un inibitore competitivo?
Un inibitore competitivo è un inibitore enzimatico che segue un meccanismo di inibizione competitiva (reversibile), ovvero compete con il substrato per il legame con il sito attivo dell'enzima.
Con quale meccanismo agisce?
L'inibitore competitivo si lega al sito attivo impedisce il legame con il substrato. L'effetto è quello di diminuire la concentrazione di enzima libero disponibile a reagire.
All'aumentare della concentrazione di inibitore diminuisce la velocità della reazione, a meno che non si aumenti anche la concentrazione di substrato.
.In conclusione il livello di inibizione dipende dunque sia dalla concentrazione di inibitore che da quella di substrato. Spesso gli inibitori competitivi hanno una forma simile a quella dei substrati di cui inibiscono il legami cioé sono strutturalmente simili al vero substrato.
Cos'é l'inibizione non competitiva?
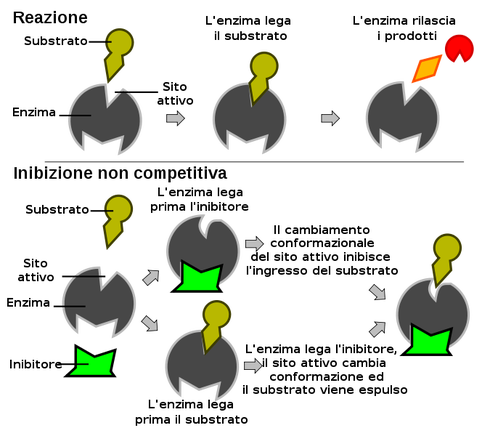
Gli inibitori non competitivi sono in grado di legare siti differenti dal sito attivo. Essi sono dunque in grado di legare sia l'enzima libero, sia in configurazione ES.
Il loro legame all'enzima genera un cambiamento conformazionale dell'enzima stesso, che può avere come conseguenza l'inibizione del legame tra enzima e substrato.
Non essendoci dunque competizione tra inibitore e substrato, l'importanza dell'inibizione dipende esclusivamente dalla concentrazione .
Il loro legame all'enzima genera un cambiamento conformazionale dell'enzima stesso, che può avere come conseguenza l'inibizione del legame tra enzima e substrato.
Non essendoci dunque competizione tra inibitore e substrato, l'importanza dell'inibizione dipende esclusivamente dalla concentrazione .
