ENERGIA DI ATTIVAZIONE
Cos'é l'energia di attivazione?
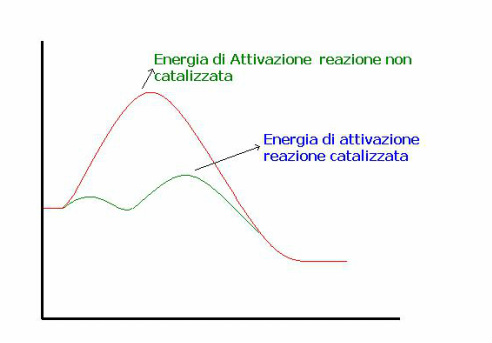
L'energia di attivazione in chimica è l'energia minima necessaria perché si realizzi una reazione chimica.
Perché una reazione avvenga è necessaria la collisione di due o più molecole opportunamente orientate e dotate di un minimo livello di energia (l'energia di attivazione, appunto), tale da permettereche la collisione, malgrado le forze elettriche repulsive generate dalle loro nubi di elettroni esterne, abbia un risultato positivo.
Se l'energia disponibile è sufficiente, le forze repulsive vengono vinte e le molecole coinvolte vengono a trovarsi ad una distanza tale da poter riorganizzare i legami tra gli atomi che le compongono e dare vita a nuovi composti (prodotti della reazione).
Perché in biologia una reazione avviene i più stati?
Esistono anche reazioni multistadio, dove il passaggio da reagenti a prodotti implica la formazione di più stadi di intermedi come avviene spesso in biologia. In questo modo l'energia non viene dissipata in calore che farebbe aumentare la temperatura a livelli incompatibili con la vita.
