PROTEINE
I componenti fondamentali della vita
Cosa sono le Proteine?
Le proteine sono composti organici complessi costituenti fondamentali di tutte le cellule animali e vegetali. Dal punto di vista chimico, una proteina è un polimero avente come monomero gli amminoacidi legati fra di loro mediante un legame peptidico. Possono essere associate ad altre molecole e/o ioni metallici (in questo caso si parla di proteina coniugata).
Quali funzioni Svolgono?
Possono avere nell'organismo una funzione energetica, come i glucidi e i lipidi; ma essa è del tutto secondaria rispetto a due altri ruoli: quello strutturale, di "materiali da costruzione", e quello di "utensili" ( = enzimi) indispensabili per "montare, smontare" e trasformare altre molecole.
Cos'é un amminoacido?
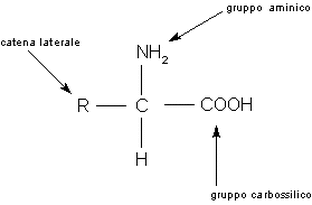
Come si vede, un atomo centrale di carbonio lega contemporaneamente:
L'atomo di carbonio al centro viene detto carbonio alfa. Ogni subunità proteica (=aminoacido) possiede dunque almeno un atomo di azoto (altri possono essere contenuti nelle catene laterali R).
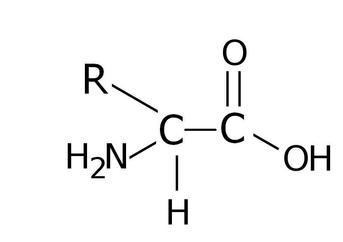
Complessivamente sono stati identificati nelle proteine 20 tipi di aminoacidi, diversi l'uno dall'altro per struttura e composizione della catena laterale.
Molte altre varietà di aminoacidi (più di 150!) si possono ancora ritrovare nelle cellule viventi, non però come costituenti di proteine, bensì come molecole singole, incaricate di funzioni particolari.
Le proteine sono composti organici complessi costituenti fondamentali di tutte le cellule animali e vegetali. Dal punto di vista chimico, una proteina è un polimero avente come monomero gli amminoacidi legati fra di loro mediante un legame peptidico. Possono essere associate ad altre molecole e/o ioni metallici (in questo caso si parla di proteina coniugata).
Quali funzioni Svolgono?
Possono avere nell'organismo una funzione energetica, come i glucidi e i lipidi; ma essa è del tutto secondaria rispetto a due altri ruoli: quello strutturale, di "materiali da costruzione", e quello di "utensili" ( = enzimi) indispensabili per "montare, smontare" e trasformare altre molecole.
Cos'é un amminoacido?
Come si vede, un atomo centrale di carbonio lega contemporaneamente:
- un gruppo amminico (basico) -NH2
- un gruppo carbossilico (acido) -COOH
- un atomo di idrogeno
- una restante porzione della molecola (detta catena laterale e indicata genericamente con R), che ha una composizione chimica variabile dall'uno all'altro aminoacido e chene influenza le proprietà chimiche
L'atomo di carbonio al centro viene detto carbonio alfa. Ogni subunità proteica (=aminoacido) possiede dunque almeno un atomo di azoto (altri possono essere contenuti nelle catene laterali R).
Complessivamente sono stati identificati nelle proteine 20 tipi di aminoacidi, diversi l'uno dall'altro per struttura e composizione della catena laterale.
Molte altre varietà di aminoacidi (più di 150!) si possono ancora ritrovare nelle cellule viventi, non però come costituenti di proteine, bensì come molecole singole, incaricate di funzioni particolari.
Aspetti generali e caratteristiche degli amminoacidi
Cosa sono gli amminoacidi essenziali?
Sono gli otto aminoacidi i che l'organismo non può sintetizzare e che deve ricevere dalla digestione: sono triptofano, fenilalanina, lisina, treonina, valina, leucina, isoleucina e metionina.Si possono definire complete o nobili quelle proteine che contengono tutti gli AA essenziali in quantità e in rapporti equilibrati.
Quelli non essenziali?
Sono quelli che il nostro organismo é in grado di sintetizza con processi vari a partire dagli amminoacidi che derivano dalla digestione delle proteine o comunque disponibili.(vedi biosintesi degli amminoacidi)
Cosa sono gli amminoacidi ramificati?
Gli aminoacidi ramificati leucina, isoleucina e valina sono per l'80% i costituenti delle proteine contrattili dei muscolo.
Durante l'attività sportiva prolungata i tre aminoacidi vengono demoliti previa trasformazione in alanina per produrre poi glucosio a livello del fegato ed infine energia. Quindi anche le proteine vengono usate come combustibile e giocano un ruolo cruciale nel provvedere a mantenere durante l'esercizio una concentrazione vitale di glucosio e nel ripristinare il glicogeno (glucosio di riserva) durante il recupero post-gara. Valutazioni recenti attribuiscono agli aminoacidi una capacità di fornitura dal 5 al 15% del fabbisogno energetico.
Come si possono classificare gli amminoacidi in base alle loro caratteristiche chimiche?.
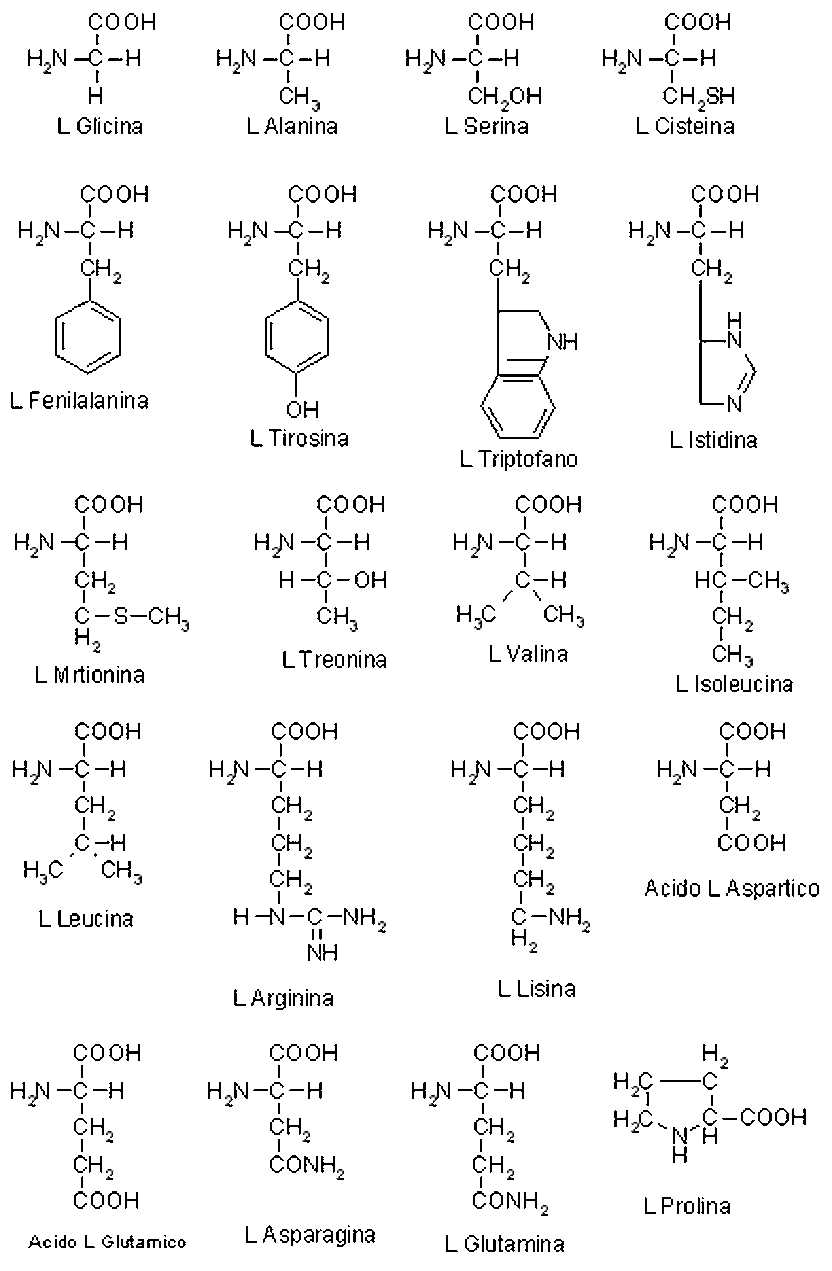
Si
possono classificare in base alle caratteristiche chimiche del gruppo R gli amminoacidi possono essere classificati come:
Quali conseguenze ci sono su ogni singolo amminoacido?
Le proprietà chimiche del gruppo R conferiscono caratteristiche particolari a ciascun amminoacido e definiscono il tipo di interazioni che si possono originare.
Cosa sono i ponti disolfuro?
Ponte disolfuro si stabiliscono fra amminoacidi che contengono lo zolfo come la cisteina
I ponti disolfuro tra i residui di cisteina stabilizzano la struttura di molte proteine.
Cos'é il legame peptidico?
Nelle proteine gli amminoacidi sono uniti mediante un legame covalente (legame peptidico).
Tale legame si stabilisce tra il gruppo carbossilico di un amminoacido ed il gruppo amminico dell’amminoacido successivo con eliminazione di una molecola di acqua (Figura 4).
Nel legame peptidico l’atomo di ossigeno del gruppo carbonilico e l’atomo di azoto del gruppo amminico sono in posizione trans.
La formazione del legame peptidico è una reazione di condensazione.
possono classificare in base alle caratteristiche chimiche del gruppo R gli amminoacidi possono essere classificati come:
- non polari (idrofobici);
- polari (senza carica);
- acidi (carichi negativamente);
- basici (carichi positivamente
Quali conseguenze ci sono su ogni singolo amminoacido?
Le proprietà chimiche del gruppo R conferiscono caratteristiche particolari a ciascun amminoacido e definiscono il tipo di interazioni che si possono originare.
- Gli amminoacidi con gruppo R non polare possono formare interazioni idrofobiche.
- Gli amminoacidi con gruppo R polare non carico possono formare legami H.
- Gli amminoacidi con gruppo R carico possono formare legami ionici.
Cosa sono i ponti disolfuro?
Ponte disolfuro si stabiliscono fra amminoacidi che contengono lo zolfo come la cisteina
I ponti disolfuro tra i residui di cisteina stabilizzano la struttura di molte proteine.
Cos'é il legame peptidico?
Nelle proteine gli amminoacidi sono uniti mediante un legame covalente (legame peptidico).
Tale legame si stabilisce tra il gruppo carbossilico di un amminoacido ed il gruppo amminico dell’amminoacido successivo con eliminazione di una molecola di acqua (Figura 4).
Nel legame peptidico l’atomo di ossigeno del gruppo carbonilico e l’atomo di azoto del gruppo amminico sono in posizione trans.
La formazione del legame peptidico è una reazione di condensazione.
Struttura delle Proteine.
Cos'é la struttura di una Proteina?
Una proteina nel suo complesso è una molecola in cui vengono convenzionalmente distinti vari livelli di organizzazione, che possono essere tre o quattro a seconda della proteina.
Cos'é la struttura primaria?
La struttura primaria è formata dalla sequenza specifica degli amminoacidi, dalla catena peptidica e dal numero stesso delle catene, determina da sola il ripiegamento della proteina.
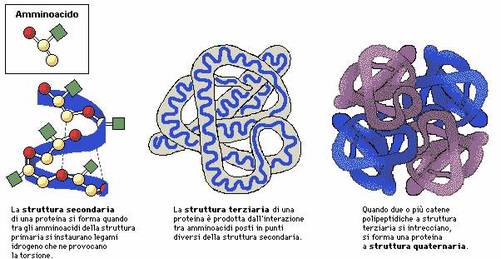
Cos'é la struttura secondaria?
La struttura secondaria consiste nella conformazione spaziale delle catene; ad esempio la conformazione a spirale (o ad alfa elica), mantenuta e consentita dai legami a idrogeno, quella planare (o a foglietto beta), il coiled coil (collagene) o quelle globulari appartenenti al gruppo KEMF (cheratina, epidermina, miosina, fibrinogeno). All'interno di una singola proteina vi può essere una combinazione di sequenze di α eliche, foglietto β e sequenze non ripetitive, e sono ad un livello di complessità compreso tra la struttura secondaria e quella terziaria.
Cos'é la struttura terziaria?
La struttura terziaria è la forma con la più bassa energia libera) è rappresentata dalla configurazione tridimensionale completa che la catena polipeptidica assume nell'ambiente in cui si trova. Una delle forze piu' importanti nel determinare la struttura terziaria delle proteine e' dovuta all' effetto idrofobico. La catena polipeptidica si riarrangia nello spazio in maniera che le catene laterali degli amminoacidi non polari siano nascoste all' interno della struttura, mentre quelle dei residui polari sono esposte sulla superficie.I legami idrogeno che si stabiliscono tra gruppi dello scheletro peptidico e le catene laterali sono importanti nella stabilizzazione della struttura terziaria che e' anche stabilizzata dai ponti disolfuro che si stabiliscono tra i residui di cisteina.Gran parte delle strutture terziarie può essere classificato come globulare o fibrosa. ( immagine da www.shikablog.it/)
Una proteina nel suo complesso è una molecola in cui vengono convenzionalmente distinti vari livelli di organizzazione, che possono essere tre o quattro a seconda della proteina.
Cos'é la struttura primaria?
La struttura primaria è formata dalla sequenza specifica degli amminoacidi, dalla catena peptidica e dal numero stesso delle catene, determina da sola il ripiegamento della proteina.
Cos'é la struttura secondaria?
La struttura secondaria consiste nella conformazione spaziale delle catene; ad esempio la conformazione a spirale (o ad alfa elica), mantenuta e consentita dai legami a idrogeno, quella planare (o a foglietto beta), il coiled coil (collagene) o quelle globulari appartenenti al gruppo KEMF (cheratina, epidermina, miosina, fibrinogeno). All'interno di una singola proteina vi può essere una combinazione di sequenze di α eliche, foglietto β e sequenze non ripetitive, e sono ad un livello di complessità compreso tra la struttura secondaria e quella terziaria.
Cos'é la struttura terziaria?
La struttura terziaria è la forma con la più bassa energia libera) è rappresentata dalla configurazione tridimensionale completa che la catena polipeptidica assume nell'ambiente in cui si trova. Una delle forze piu' importanti nel determinare la struttura terziaria delle proteine e' dovuta all' effetto idrofobico. La catena polipeptidica si riarrangia nello spazio in maniera che le catene laterali degli amminoacidi non polari siano nascoste all' interno della struttura, mentre quelle dei residui polari sono esposte sulla superficie.I legami idrogeno che si stabiliscono tra gruppi dello scheletro peptidico e le catene laterali sono importanti nella stabilizzazione della struttura terziaria che e' anche stabilizzata dai ponti disolfuro che si stabiliscono tra i residui di cisteina.Gran parte delle strutture terziarie può essere classificato come globulare o fibrosa. ( immagine da www.shikablog.it/)
Cos'é la struttura Quaternaria.
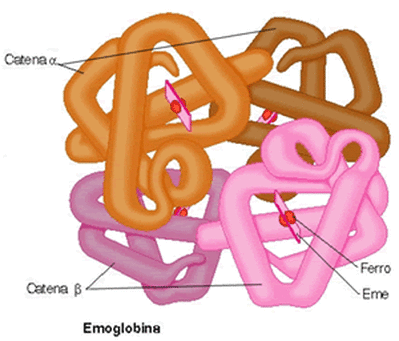
La struttura quaternaria e' dovuta alla associazione di due o piu' catene polipeptidiche che si riarrangiano in una struttura a piu' sub-unita'. Nelle proteine che presentano tale struttura ciascuna sub-unita' assume una propria struttura terziaria stabile e successivamente esse si associano per dar vita alla struttura finale.La struttura quaternaria e' stabilizzata principalmente dalle interazioni non covalenti; e cioe' da: legami idrogeno, interazioni di van der Walls e legami ionici. In alcuni casi i ponti disolfuro intevengono anche per stabilizzare la struttura quaternaria. Tipica proteina con struttura quaternaria é l'emoglobina.( immagine da http://www.shikablog.it/)
