ENERGIA
Metabolismo, Energia, Energia Libera, Entropia, Reazioni Accoppiate
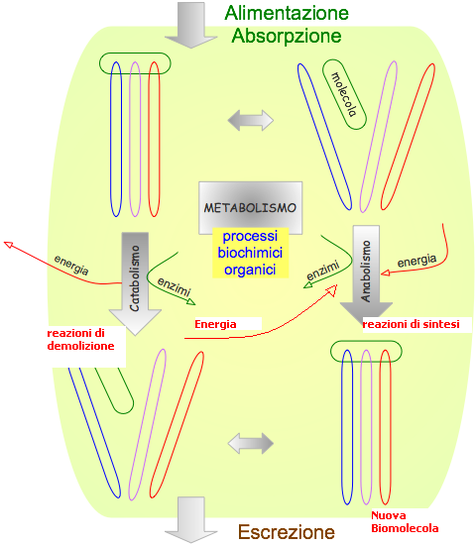
Cos'é ilmetabolismo?
Il metabolismo è l’insieme di reazioni biochimiche che negli organismi trasformano grandi quantità di sostanze grazie alla presenza di biocatalizzatori (ENZIMI).
Per quali scopi?
1- ottenere energia chimica
2- convertire le sostanze nutrienti in molecole caratteristiche delle cellule
3- polimerizzare monomeri in polimeri
4- sintetizzare e degradare le biomolecole necessarie per le funzioniIl catabolismo converte le sostanze nutrienti ricche di energia (carboidrati, grassi, proteine, acidi nucleici) in prodotti finali (poveri di energia) ed energia cellulare: Sostanze nutrienti CO2+ H2O + energia
Da dove traggono l'energia gli esseri viventi?
Gli organismi viventi per conservare le proprie strutture altamente organizzate hanno sviluppato meccanismi molto efficaci per catturare l'energia dalla luce del sole (organismi fotosintetici) o per estrarla da sostanze ossidabili e accoppiarla ai processi che questa energia consumano. In quest’ultimo caso esse prelevano molecole dall’ambiente, i nutrienti, dai quali, tramite i processi degradativi, (catabolici) e attraverso processi ossidativi trasferiscono l'energia all'ATP.
Sono le reazioni esoergoniche di demolizione che rendono disponibile l’energia da usare per fare avvenire i processi che consumano energia come il lavoro meccanico, il lavoro osmotico ed elettrico, il trasferimento dell'informazione genetica, il mantenimento dell'omeostasi termica e i numerosi processi biosintetici, riduttivi, quelli delle reazioni endoergoniche che oltre a produrre molecole importanti per la funzionalità della cellula, concorrono al mantenimento delle strutture ordinate degli organuli cellulari.
Il metabolismo è l’insieme di reazioni biochimiche che negli organismi trasformano grandi quantità di sostanze grazie alla presenza di biocatalizzatori (ENZIMI).
Per quali scopi?
1- ottenere energia chimica
2- convertire le sostanze nutrienti in molecole caratteristiche delle cellule
3- polimerizzare monomeri in polimeri
4- sintetizzare e degradare le biomolecole necessarie per le funzioniIl catabolismo converte le sostanze nutrienti ricche di energia (carboidrati, grassi, proteine, acidi nucleici) in prodotti finali (poveri di energia) ed energia cellulare: Sostanze nutrienti CO2+ H2O + energia
Da dove traggono l'energia gli esseri viventi?
Gli organismi viventi per conservare le proprie strutture altamente organizzate hanno sviluppato meccanismi molto efficaci per catturare l'energia dalla luce del sole (organismi fotosintetici) o per estrarla da sostanze ossidabili e accoppiarla ai processi che questa energia consumano. In quest’ultimo caso esse prelevano molecole dall’ambiente, i nutrienti, dai quali, tramite i processi degradativi, (catabolici) e attraverso processi ossidativi trasferiscono l'energia all'ATP.
Sono le reazioni esoergoniche di demolizione che rendono disponibile l’energia da usare per fare avvenire i processi che consumano energia come il lavoro meccanico, il lavoro osmotico ed elettrico, il trasferimento dell'informazione genetica, il mantenimento dell'omeostasi termica e i numerosi processi biosintetici, riduttivi, quelli delle reazioni endoergoniche che oltre a produrre molecole importanti per la funzionalità della cellula, concorrono al mantenimento delle strutture ordinate degli organuli cellulari.
OSSIDAZIONI BIOLOGICHE.
Perchè le ossidazioni biologiche sono in grado di fornire energia?
L'energia viene liberata in successivi processi di ossidazione e momentaneamente immagazzinata dai coenzimi allo stato ridotto.
Nell'ultima fase della respirazione cellulare la riossidazione dei coenzimi e il conseguente flusso elettronico consentono di ottenere ATP.
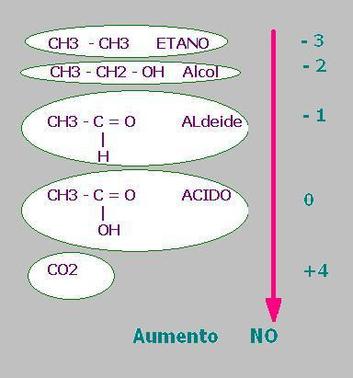
La figura mostra cinque diversi stati d'ossidazione del C: partendo dal più ridotto (nell'alcano, nella tabella) a quello più ossidato: il diossido di C.
L'etano è un idrocarburo ed il C si trova a condividere i doppietti elettronici con un atomo meno elettronegativo ( H).
Il risultato è che il C, negli idrocarburi, è ad un alto stato di riduzione e questo comporta che la sua ossidazione libera una elevata quantità d'energia. Ecco perché gli idrocarburi sono combustibili largamente usati per produrre energia. Passando da un idrocarburo ad un alcol si ha una ossidazione perché quest' ultimo presenta un legame C-O.
Nel suo insieme l'alcol mantiene comunque un alto grado di riduzione: ecco perché le bevande alcoliche sono alimenti energetici.
L'aldeide presenta uno stato d'ossidazione superiore a quello dell'alcol perché un atomo di C condivide due doppietti elettronici con l'O, l'atomo più elettronegativo tra gli elementi (F escluso). Gli acidi organici hanno un C ancora più ossidato.
Ma anche dagli acidi e, a maggior ragione dalle aldeidi, è ancora possibile estrarre energia ossidandoli ad anidride carbonica (diossido di C) che è la forma più ossidata del carbonio.
Una ossidazione (combustione) è completa quando i prodotti finali sono CO2 e H2O
Possiamo scrivere così una reazione generale e semplificata:
C6H12O6 +6O2 ---> 6CO2 + 6H2O + ENERGIA
E' evidente una "scala" di ossidazione del carbonio che in senso crescente è :
Idrocarburi →Alcol →Aldeide →Acido →Anidride carbonica.
Passare, in questo ordine, dall'uno all'altro è una ossidazione. Nell'ordine inverso è una
riduzione.
• Tutte queste reazioni di ossidazione sono in grado di liberare energia e quindi sono reazioni esoergoniche, con ∆G < 0.
• In queste reazioni si passa da composti ordinati e più complessi a composti più semplici e più caotici ( livello energetico inferiore) (∆S > 0).
• Essendo i prodotti ad un livello energetico inferiore esse sono reazioni "in discesa" e quindi spontanee.
Anche se tali reazioni sono favorite, nelle cellule avvengono, nei tempi compatibili con la vita, perché sono catalizzate da enzimi che ne abbassano l'energia d'attivazione.
Le sostanze ossidabili contengono una certa quantità di energia di legame che viene gradatamente liberata da sistemi multienzimatici che formano le vie o i cicli metabolici. Una parte di questa energia sarà energia utile capace di essere sfruttata per compiere un lavoro ed una parte si disperderà nell'ambiente sotto forma di fattori entropici.
L'energia viene liberata in successivi processi di ossidazione e momentaneamente immagazzinata dai coenzimi allo stato ridotto.
Nell'ultima fase della respirazione cellulare la riossidazione dei coenzimi e il conseguente flusso elettronico consentono di ottenere ATP.
La figura mostra cinque diversi stati d'ossidazione del C: partendo dal più ridotto (nell'alcano, nella tabella) a quello più ossidato: il diossido di C.
L'etano è un idrocarburo ed il C si trova a condividere i doppietti elettronici con un atomo meno elettronegativo ( H).
Il risultato è che il C, negli idrocarburi, è ad un alto stato di riduzione e questo comporta che la sua ossidazione libera una elevata quantità d'energia. Ecco perché gli idrocarburi sono combustibili largamente usati per produrre energia. Passando da un idrocarburo ad un alcol si ha una ossidazione perché quest' ultimo presenta un legame C-O.
Nel suo insieme l'alcol mantiene comunque un alto grado di riduzione: ecco perché le bevande alcoliche sono alimenti energetici.
L'aldeide presenta uno stato d'ossidazione superiore a quello dell'alcol perché un atomo di C condivide due doppietti elettronici con l'O, l'atomo più elettronegativo tra gli elementi (F escluso). Gli acidi organici hanno un C ancora più ossidato.
Ma anche dagli acidi e, a maggior ragione dalle aldeidi, è ancora possibile estrarre energia ossidandoli ad anidride carbonica (diossido di C) che è la forma più ossidata del carbonio.
Una ossidazione (combustione) è completa quando i prodotti finali sono CO2 e H2O
Possiamo scrivere così una reazione generale e semplificata:
C6H12O6 +6O2 ---> 6CO2 + 6H2O + ENERGIA
E' evidente una "scala" di ossidazione del carbonio che in senso crescente è :
Idrocarburi →Alcol →Aldeide →Acido →Anidride carbonica.
Passare, in questo ordine, dall'uno all'altro è una ossidazione. Nell'ordine inverso è una
riduzione.
• Tutte queste reazioni di ossidazione sono in grado di liberare energia e quindi sono reazioni esoergoniche, con ∆G < 0.
• In queste reazioni si passa da composti ordinati e più complessi a composti più semplici e più caotici ( livello energetico inferiore) (∆S > 0).
• Essendo i prodotti ad un livello energetico inferiore esse sono reazioni "in discesa" e quindi spontanee.
Anche se tali reazioni sono favorite, nelle cellule avvengono, nei tempi compatibili con la vita, perché sono catalizzate da enzimi che ne abbassano l'energia d'attivazione.
Le sostanze ossidabili contengono una certa quantità di energia di legame che viene gradatamente liberata da sistemi multienzimatici che formano le vie o i cicli metabolici. Una parte di questa energia sarà energia utile capace di essere sfruttata per compiere un lavoro ed una parte si disperderà nell'ambiente sotto forma di fattori entropici.
Reazioni Esoergoniche e endoergoniche
cosa sono le reazioni esorgoniche?
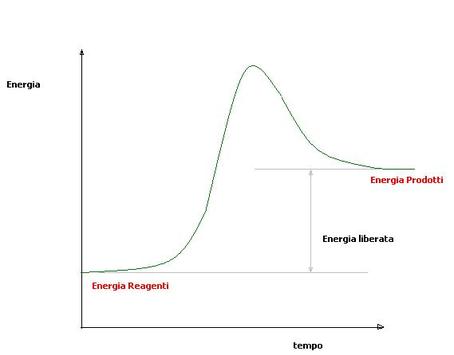
Vengono chiamate esoergoniche quelle reazioni in cui il contenuto di energia dei prodotti è minore rispetto a quello dei reagenti: si è avuta quindi una liberazione di energia verso l'esterno.Un esempio di reazione esoergonica può essere quello della demolizione del glucosio, ma più in generale ogni reazione del catabolismo.
Nel grafico accanto (fig. 1) è riportato l'andamento della variazione di energia in funzione del tempo di reazione.In questo caso i reagenti hanno un contenuto energetico superiore a quello dei prodotti: l'energia mancante è stata liberata nell'ambiente.Paragraph. Fai clic qui per effettuare modifiche.
Vengono chiamate esoergoniche quelle reazioni in cui il contenuto di energia dei prodotti è minore rispetto a quello dei reagenti: si è avuta quindi una liberazione di energia verso l'esterno.Un esempio di reazione esoergonica può essere quello della demolizione del glucosio, ma più in generale ogni reazione del catabolismo.
Nel grafico accanto (fig. 1) è riportato l'andamento della variazione di energia in funzione del tempo di reazione.In questo caso i reagenti hanno un contenuto energetico superiore a quello dei prodotti: l'energia mancante è stata liberata nell'ambiente.Paragraph. Fai clic qui per effettuare modifiche.
Reazioni Endoergoniche.
Cosa sono le reazioni Endorgoniche?
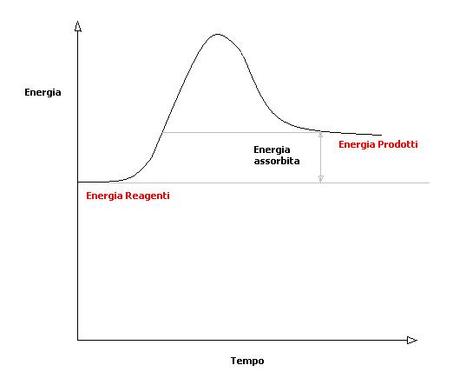
Vengono chiamate endoergoniche quelle reazioni in cui il contenuto di energia dei prodotti è maggiore rispetto a quello dei reagenti: si è avuta quindi un assorbimento di energia dell'esterno.
Un esempio di reazione endoergonica può essere quello della sintesi del glucosio nella fotosintesi , ma più in generale ogni reazione dell'anabolismo.
Nel grafico si osserva che il contenuto energetico dei prodotti è superiore a quello dei reagenti: c'è stato un assorbimento di energia
Perchè le ossidazioni biologiche liberano energia?
Le reazioni metaboliche come le possiamo dividere?
Si dividono in catabolismo e anabolismo.
ll catabolismo converte le macromolecole ricche di energia (carboidrati, grassi, proteine, acidi nucleici) in prodotti finali più semplici poveri di energia come molecole che sono precursori di molecole complesse, CO2+ H2O ed energia disponibile per le cellule
L’anabolismo genera molecole complesse (macromolecole cellulari: carboidrati, grassi, proteine, acidi nucleici) da molecole semplici (precursori: aminoacidi, zuccheri, acidi grassi, basi azotate) utilizzando energia:Energia + precursori
Le vie cataboliche rilasciano energia libera, parte della quale viene conservata mediante la formazione di ATP (ENERGIA CHIMICA) e trasportatori di elettroni in forma ridotta (NADH, NADPH e FADH2).
Le vie anaboliche hanno invece bisogno di un rifornimento di energia sotto forma (ATP) e potere riducente (NADH, NADPH e FADH2) e Metaboliti complessi
Quali leggi seguono le trasformazioni Biologiche?
Tutte le trasformazioni energetiche che avvengono in natura seguono le leggi della termodinamica e gli esseri viventi non sfuggono a questi principi.
Le cellule sono trasformatori di energia efficacissimi e sono sistemi termodinamici che operano a temperatura costante.
Cosa dicono le leggi della termodinamica?
Il primo principio della termodinamica è il principio della conservazione dell’energia, quello che ci ricorda che l’energia non si può né creare né distruggere ma solo trasformare e quindi che l’energia totale sistema-ambiente è costante. Un'altro modo di enunciare il primo principio è "l'energia totale scambiata in un sistema termodinamico è indipendente dal percorso che si compie nelle trasformazioni ma dipende dal punto iniziale e da quello finale. Così la quantità di energia liberata dall’ossidazione del glucosio in una bomba calorimetria, che avviene in una frazione di secondo e in un'unica tappa, è la stessa liberata dalla cellula nel lungo e complesso percorso catabolico.
Il secondo principio della termodinamica introduce il concetto di entropia(S), che è l’equivalente matematico del disordine molecolare
Il secondo principio dice che in ogni trasformazione energetica la somma delle variazioni di entropia del sistema-universo aumenta. Come dire che in tutte le reazioni con scambi d’energia il disordine molecolare dell’universo aumenta.
Se consideriamo una cellula il sistema e l’ambiente intorno l’universo avremo che: .
∆S universo + ∆S sistema > 0
Cos'é l'energia libera?
Anche i sistemi biologici seguono le leggi della termodinamica .
L'energia libera di un sistema è la quantità di lavoro macroscopico che il sistema può compiere sull'ambiente, cioè nel nostro caso è l'energia a disposizione per i processi metabolici.
Essa è funzione della temperatura, della pressione e della concentrazione della specie chimica considerata
In una reazione esoergonica il sistema perde energia libera per cui la differenza di energia libera é negatva Δ G < 0 perché l'energia dei Prodotti é inferiore a quella dei reagent,i mentre per le reazioni endoergoniche Δ G > 0, cioè l'energia dei prodotti é superiore a quella dei reagenti, per cui bisogna fornire energia, altrimenti la reazione non avviene.
Cos'è l'entropia?
Ogni volta che una certa quantità di energia viene convertita da uno stato ad un altro si ha una penalizzazione che consiste nella degradazione di una parte dell'energia stessa in forma di calore, in particolare questa parte non sarà più utilizzabile per produrre lavoro.
In altre parole ciò significa che non solo non si può né creare né distruggere l'energia, ma nemmeno la si può completamente trasformare da una forma in un'altra, senza che una parte venga dissipata sotto forma di calore.
Se per esempio si brucia un pezzo di carbone, la sua energia si conserva e si converte in energia contenuta nell'anidride carbonica, nell'anidride solforosa e negli altri residui di combustione oltre che naturalmente in forma di calore.
Per quanto non si sia persa energia nel processo, sappiamo che non possiamo invertire il processo di combustione e ricreare dai suoi scarti il pezzo di carbone originale.di conseguenza l'entropia o stato di disordine tende ad aumentare.
Come avviene il trasporto dell'energia?
Il trasporto dell’energia viene affidato a delle molecole trasportatrici di energia, esse sono:
1. ATP: i legami che uniscono i due gruppi fosfato terminali vengono detti legami ad alta energia ed è il legamo tra il secondo e il terzo gruppo fosfato a trasferire l’energia delle reazioni esoergoniche a quelle endoergoniche. Quando l’ATP libera l’energia si trasforma in ADP e riprende il gruppo fosfato perso nella reazione esoergonica.
2. Trasportatori di elettroni: trasportatori di elettorni sono ad esempio l’NAD+ e il FAD
Reazioni Accoppiate
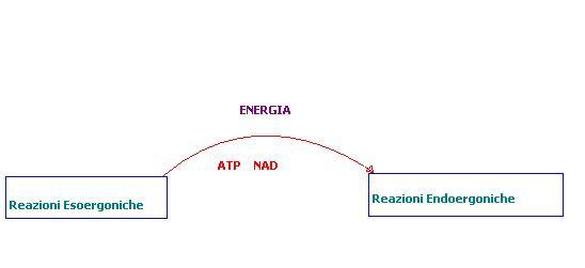
.
Gli organismi viventi hanno la necessità e la peculiarità di conservare le proprie strutture altamente organizzate e mantenere un preciso ordine interno attivando processi che possano contrastare l’inesorabile degrado della materia.
Le cellule hanno sviluppato meccanismi molto efficaci per catturare l'energia dalla luce del sole (organismi fotosintetici) o per estrarla da sostanze ossidabili e accoppiarla ai processi che questa energia consumano. In quest’ultimo caso esse prelevano molecole dall’ambiente, i nutrienti, dai quali, tramite i processi degradativi, (catabolici) trasferiscono l'energia all'ATP.
Sono le reazioni esoergoniche di demolizione che rendono disponibile l’energia da usare per fare avvenire i processi che consumano energia come il lavoro meccanico, il lavoro osmotico ed elettrico, il trasferimento dell'informazione genetica, il mantenimento dell'omeostasi termica e i numerosi processi biosintetici, riduttivi, quelli delle reazioni endoergoniche che oltre a produrre molecole importanti per la funzionalità della cellula, concorrono al mantenimento delle strutture ordinate degli organuli cellulari.
Le reazioni accoppiate sfruttano l’energia liberata dalle reazioni esoergoniche per attivare le reazioni endoergoniche, in altre parole queste ultime possono avvenire solo a spese delle prime che gli fornisce l'energia necessaria.
Gli organismi viventi hanno la necessità e la peculiarità di conservare le proprie strutture altamente organizzate e mantenere un preciso ordine interno attivando processi che possano contrastare l’inesorabile degrado della materia.
Le cellule hanno sviluppato meccanismi molto efficaci per catturare l'energia dalla luce del sole (organismi fotosintetici) o per estrarla da sostanze ossidabili e accoppiarla ai processi che questa energia consumano. In quest’ultimo caso esse prelevano molecole dall’ambiente, i nutrienti, dai quali, tramite i processi degradativi, (catabolici) trasferiscono l'energia all'ATP.
Sono le reazioni esoergoniche di demolizione che rendono disponibile l’energia da usare per fare avvenire i processi che consumano energia come il lavoro meccanico, il lavoro osmotico ed elettrico, il trasferimento dell'informazione genetica, il mantenimento dell'omeostasi termica e i numerosi processi biosintetici, riduttivi, quelli delle reazioni endoergoniche che oltre a produrre molecole importanti per la funzionalità della cellula, concorrono al mantenimento delle strutture ordinate degli organuli cellulari.
Le reazioni accoppiate sfruttano l’energia liberata dalle reazioni esoergoniche per attivare le reazioni endoergoniche, in altre parole queste ultime possono avvenire solo a spese delle prime che gli fornisce l'energia necessaria.
