Legami Chimici
Elettronegatività e legami
L’elettronegatività misura la capacità di ciascun atomo ad attirare gli elettroni coinvolti in un legame. L’elemento più elettronegativo è il fluoro 4,0, molto elettronegativi sono tutti i non metalli del VII° gruppo ed anche Ossigeno 3,5 ed Azoto 3,0. I meno Elettronegativi sono i metalli del I° e II° gruppo.
La differenza di elettronegatività può sommariamente determinare i seguenti legami:
< 0,4 il legame è covalente puro o quasi puro
da 0,4 a 1,8 il legame è covalente polare
> 1,8 il legame è ionico
Legame covalente : è il legame che si realizza fra due atomi mettendo in comune due o più elettroni delle orbite esterne. E' il tipico legame che troviamo nei composti organici, fondamentale in diverse molecole biologiche:
C – C , C – N , C = O , S – S , etc.
Il legame covalente puro o debolmente polare e tipico delle molecole pluriatomiche dello stesso elemento es.O2 ecc e ad esempio di tutti gli idrocarburi dove la differenza di elettronegatività del legame C-H è 0,4. In questo caso le molecole sono apolari e le uniche forze intermolecolari sono le forze di Wan der Wals.
Il legame covalente polare si instaura tra due atomi con differenza di elettronegatività compresa tra 0,5 e 1,8 ,ma non tanto diversa da rendere possibile la formazione di un legame ionico. In questo caso, gli elettroni coinvolti nel legame risulteranno maggiormente attratti dall'atomo più elettronegativo, il legame risulterà quindi polarizzato elettricamente, cioè ognuno degli atomi coinvolti nel legame presenterà una carica elettrica parziale.
Una molecola costituita da due atomi legati fra loro da un legame covalente polare è polare (o dipolo elettrico); ciò non significa, in genere, però che la molecola abbia una carica elettrica perché nella sua totalità essa è elettricamente neutra. Si può prevedere facilmente la struttura polare di una molecola nel caso essa sia biatomica.
Legame ionico
IL legame ionico si forma fra atomi che hanno una forte differenza di elettronegatività cioè la cui differenza dei valori è superiore a 1,8.
Si stabilisce tra gruppi aventi cariche elettriche opposte (Na+ Cl- ). Quando due atomi si avvicinano (un metallo e un atomo di un elemento degli ultimi gruppi), gli elettroni del livello più esterno dell’atomo meno elettronegativo (metallo con pochi elettroni di valenza) passano all’atomo più elettronegativo (non metallo con tanti elettroni di valenza).
Quest’ultimo diviene quindi uno ione negativo, mentre l’altro atomo diviene uno ione positivo. Diventa relativamente debole in ambiente acquoso. Nelle proteine si realizza tra i gruppi polari di aminocidi basici carichi positivamente (Lys e Arg) e aminoacidi acidi carichi negativamente (Glu e Asp).
Fra i due ioni con cariche elettriche opposte si stabilisce un’attrazione di tipo elettrostatico che li tiene uniti: quest’attrazione costituisce il legame. I composti contenenti legami ionici sono chiamati composti ionici (NaCl, MgCl2, ecc).
Legame idrogeno : (avviene tra diverse molecole) Se l’idrogeno (H) è legato a un atomo fortemente elettronegativo (O, N, F) ci sarà un’attrazione degli elettroni di legame da parte di quest’ultimo. Si formerà così un dipolo di cui l’H sarà la parte positiva. E’ un legame debole che viene comunemente indicato con una linea punteggiata.
Forze di van der WAALS : (avviene tra tutti gli atomi legati covalentemente) esse sono responsabili di genereriche forze attrattive tra i nuclei e gli elettroni degli atomi. Dipendono dalla distanza a cui gli atomi si trovano tra loro. Se gli atomi sono troppo vicini prevalgono le forze di repulsione. Sono forze che variano ad ogni momento . Sono le tipiche forze intermolecolari delle catene idrocarburiche,
Molecole polari e apolari
Una molecola è apolare quando le cariche positive (dei protoni) e negative (degli elettroni) sono distribuite in modo che non ci sia una parte positiva ed una parte negativa della molecola.
Forse ti stai chiedendo da che cosa dipenda ciò. Ebbene i fattori importanti sono due: la polarità dei legami covalenti all'interno della molecola e la forma della molecola. Quando i legami sono apolari la molecola è sicuramente apolare e non c'è bisogno di considerare la forma della molecola (per es. le molecole degli elementi I2, P4 e S8).
Quando i legami sono polari si possono verificare due casi:
la molecola è simmetrica: in questo caso la molecola è apolare (è il caso dell'anidride carbonica, CO2) anche se la differenza di elettronegatività è 1,4
Click here to edit.
Molecola Apolare
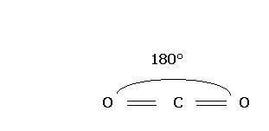
Nella molecola dell'anidride carbonica un atomo di carbonio centrale è unito a due atomi di ossigeno tramite legami doppi covalenti polari. La disposizione dei legami è speculare rispetto al piano indicato con la linea azzurra tratteggiata, le due polarizzazioni quindi si annullano l'una con l'altra e la molecola risulta apolare.Il carbonio forma due legami covalenti doppi con due atomi di ossigeno e c'è un angolo di legame di 180°.
Il legame tra C e O è polare( EC = 2,5 ; EO = 3,5 ) , ma i due dipoli sono esattamente opposti e la molecola risulterà complessivamente apolare poiché le cariche opposte sullo stesso piano si annullano.
Il legame tra C e O è polare( EC = 2,5 ; EO = 3,5 ) , ma i due dipoli sono esattamente opposti e la molecola risulterà complessivamente apolare poiché le cariche opposte sullo stesso piano si annullano.
Molecola Polare
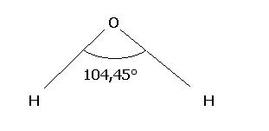
La molecola è asimmetrica: in questo caso la molecola risulta essere polare (è il caso dell'acqua, H2O angolo di legame circa 104°,45°).
Il legame tra l’ossigeno e l’idrogeno è polare (EO=3,5 ; EH = 2,1), ciò significa che gli elettroni di legame sono più spostati verso l’ossigeno. Ciò causa una parziale carica negativa sull'ossigeno (a causa della carica negativa degli elettroni). Per lo stesso motivo la parte degli atomi di idrogeno presenta una parziale carica positiva). Queste due cariche poste ad una certa distanza costituiscono un dipolo. Un dipolo si rappresenta con una freccia che punta verso la zona negativa della molecola.
Il tipo di legame chimico che si stabilisce tra atomi, ioni e molecole determina fenomeni diversi come:
Il legame tra l’ossigeno e l’idrogeno è polare (EO=3,5 ; EH = 2,1), ciò significa che gli elettroni di legame sono più spostati verso l’ossigeno. Ciò causa una parziale carica negativa sull'ossigeno (a causa della carica negativa degli elettroni). Per lo stesso motivo la parte degli atomi di idrogeno presenta una parziale carica positiva). Queste due cariche poste ad una certa distanza costituiscono un dipolo. Un dipolo si rappresenta con una freccia che punta verso la zona negativa della molecola.
Il tipo di legame chimico che si stabilisce tra atomi, ioni e molecole determina fenomeni diversi come:
- la miscibilità e la solubilità delle sostanze, quando si formano soluzioni
- · la conducibilità elettrica, sia delle sostanze che delle soluzioni.
